2024年7月9日在欧盟公报上正式发布IVDR 更新版本法规,在年初提出的延期提案终于在7月份落地,给广大的体外诊断试剂厂家提供了更多的时间准备IVDR 下的产品注册。
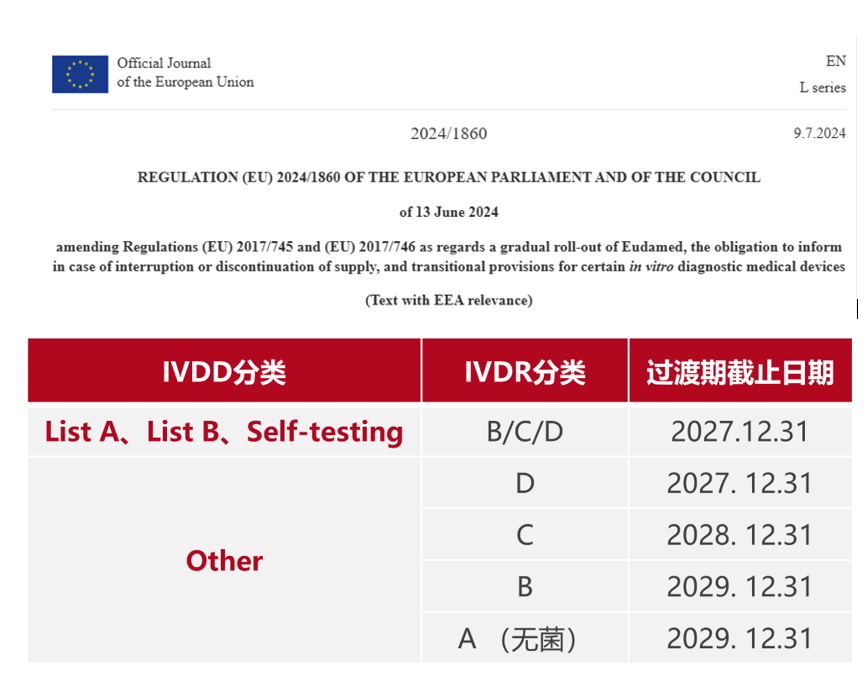
要延期到以上的过渡时间,前提是需要满足以下要求:
(1)这些产品继续符合指令 98/79/EC的要求;
(2)设计和预期用途没有重大变化;
(3)这些产品不会对患者、用户或其他人员的健康或安全或保护公众健康的其他方面构成不可接受的风险;
(4)不迟于2025年5月26日,制造商已根据第10(8)条建立了质量管理体系;
(5) 制造商或授权代表已根据附件VII第4.3条第1款向公告机构提出正式IVDR注册申请,要求对本条第3a条款或3b条款所述的器械或旨在替代该器械的器械进行合格评定,不迟于:

公司获悉该法规落地的同时,即向公告机构提出我司 PSA/FPSA 检测试剂两个产品的延期申请,该两个产品在延期法规生效前,我司已经向公告机构申请进行IVDR 的注册,并且已经签订IVDR合同,因此符合以上所列法规的关于准许延期的要求。
提交延期申请后,一直积极跟公告机构沟通,并在本周获得公告机构的正式确认函,顺利延期至 2027-12-31. 该产品顺利延期为我司海外市场的正常产品生产和销售提供了法规保证,和为生产以及供货提供了过渡时间,确保不断货,满足客户的供货要求。

同时公司将继续积极推进该产品的IVDR 注册,争取早日取得IVDR证书,为拓宽海外市场提供更有力的法规保障。
更多海外产品信息,欢迎来电/邮件咨询。
联系人: 梁小姐
电话:13510735784
邮箱:candy.liang@ksbbiotech.com